1. Kỹ thuật xét nghiệm nhanh:
Kỹ thuật xét nghiệm nhanh được chia thành môṭ số loại nguyên lý sau:
- Miễn dịch chấm - thấm.
- Miễn dịch lọc.
- Miễn dịch sắc ký, đây là nguyên lý kỹ thuật phổ biến trong các sinh phẩm nhanh HIV trên thị trường Việt Nam.
Đặc điểm chung của các xét nghiệm nhanh là đơn giản, thời gian xét nghiệm trong vòng 30 phút.
Theo Tổ chức Y tế thế giới, các sinh phẩm chẩn đoán nhanh thường được dùng ở những phòng xét nghiệm có số lượng mẫu < 40 mẫu/ngày, những nơi có điều kiện hạn chế về trang thiết bị, vùng sâu vùng xa. Việc sử dụng sinh phẩm nhanh cho phép triển khai xét nghiệm HIV mở rộng và trả kết quả sớm trong ngày, tăng tỷ lệ nhận kết quả xét nghiệm và tăng kết nối điều trị.
Với sự phát triển của khoa học công nghệ, ngày nay các kỹ thuật xét nghiệm nhanh có độ nhạy và độ đặc hiệu cao tương đương với kỹ thuật ELISA. Một số sinh phẩm nhanh còn cho phép phân biệt được nhiễm HIV-1 và HIV-2.
1.1. Các xét nghiệm miễn dịch chấm - thấm, miễn dic̣h lọc.
- Là kỹ thuật dựa trên nguyên tắc miễn dịch đánh dấu trên màng lọc.
- Màng phản ứng chứa những hạt vi lượng bao phủ kháng nguyên HIV-1 và HIV-2, đồng thời có một vùng chứng để kiểm tra phản ứng.
- Kháng thể kháng HIV có trong huyết thanh hoặc huyết tương người được làm xét nghiệm sẽ gắn với kháng nguyên trên màng lọc. Sau đó, phức hợp kháng nguyên-kháng thể này được phát hiện bởi cộng hợp có gắn enzymcho phản ứng hiện màu với cơ chất.
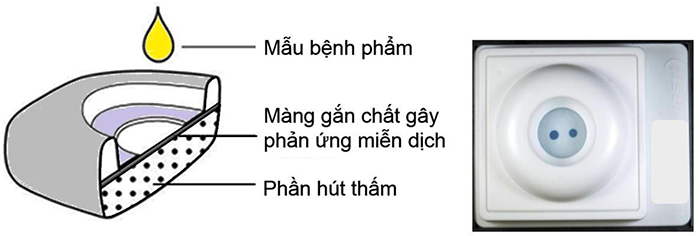
Hình 1: Kỹ thuật xét nghiệm miễn dịch đánh dấu trên màng lọc
1.2. Các xét nghiệm miễn dịch sắc ký.
- Mẫu bệnh phẩm được nhỏ lên vùng nhỏ mẫu thử. Huyết thanh/huyết tương sẽ thấm qua vùng có chứa cộng hợp là kháng nguyên vi rút đã gắn với một chất đánh dấu màu và tiếp tục dịch chuyển qua vùng phản ứng đã cố định kháng nguyên. Nếu mẫu thử có kháng thể đặc hiệu với HIV sẽ cho phản ứng dương tính là một vạch màu ở vị trí này. Cộng hợp kháng nguyên vi rút gắn đánh dấu màu tiếp tục dịch chuyển lên vùng chứng phía trên là vị trí đã cố định sẵn kháng thể đơn dòng đặc hiệu với HIV và cho một vạch phản ứng màu (vạch chứng của phản ứng).
- Xét nghiệm dương tính khi có hai vạch màu ở vùng phản ứng và vùng kiểm chứng.
- Xét nghiệm âm tính khi chỉ có vạch màu ở vùng kiểm chứng.
- Xét nghiệm không có giá trị nếu không có vạch màu ở vùng chứng, khi đó phải thực hiện lại xét nghiệm mẫu đó trên thanh sinh phẩm mới.
.jpg)
Hình 2: Nguyên lý kỹ thuật xét nghiệm miễn dịch sắc ký
Ngày nay một số sinh phẩm nhanh cho phép phát hiện đồng thời cả kháng nguyên p24 và kháng thể kháng HIV trong mẫu bệnh phẩm.
Ưu điểm và nhược điểm của các kỹ thuật xét nghiệm nhanh
- Ưu điểm:
+ Thuận lợi khi số lượng mẫu ít.
+ Dễ thực hiện, cho kết quả nhanh, có thể đọc kết quả bằng mắt thường.
+ Không đòi hỏi các trang thiết bị.
+ Dễ bảo quản sinh phẩm.
+ Cán bộ xét nghiệm có thể được đào tạo nhanh.
+ Với các sinh phẩm sử duṇg được cả máu toàn phần thích hợp cho việc áp dụng chích máu đầu ngón tay để xét nghiệm chẩn đoán HIV ở những nơi điều kiện đi lại khó khăn.
- Nhược điểm:
+ Không thuận lợi khi số mẫu xét nghiệm nhiều.
+ Không lưu được dữ liệu kết quả.
+ Kết quả đọc phụ thuộc chủ quan vào người đọc.
Mặc dù xét nghiệm nhanh đơn giản nhưng cũng có nhiều yếu tố ảnh hưởng đến kết quả XN HIV:
- Lượng bệnh phẩm nhỏ vào phải đủ thể tích yêu cầu: khi cho không đủ mẫu có thể cho kết quả âm tính giả (đặc biệt với trường hợp mới nhiễm hoặc đáp ứng miễn dịch không đầy đủ có nồng độ kháng thể thấp).
- Đảm bảo đúng thời gian đọc kết quả xét nghiệm: đây là yếu tố quan troṇg nhất đảm bảo kết quả xét nghiệm chính xác.
+ Đọc kết quả sớm hơn thời gian quy định có thể cho kết quả âm tính giả.
+ Đọc kết quả muộn hơn thời gian quy định có thể cho kết quả dương tính giả.
- Sinh phẩm phải được bảo quản đúng quy định về độ ẩm và nhiệt đô: nhìn chung một số sinh phẩm nhanh yêu cầu nhiệt đô ̣ bảo quản từ 2-30oC, tuy nhiên nếu nhiệt độ bảo quản không đúng (trên 300C vào mùa hè ), hoặc độ ẩm cao sẽ ảnh hưởng nhiều đến chất lượng sinh phẩm và kết quả xét nghiệm.
2. Kỹ thuật xét nghiệm ngưng kết hạt vi lượng (Microtiter particle agglutination)
Kỹ thuật ngưng kết hạt vi lượng được coi là đơn giản.
Những hạt hữu hình (gelatin, latex, hồng cầu) được gắn với các thành phần kháng nguyên của vi rút HIV -1/HIV-2 sẽ cho phản ứng ngưng kết khi có sự hiện diện của kháng thể đặc hiệu với HIV nếu có trong mẫu thử.
Thành phần của sinh phẩm là những hạt gelatin đã được gắn kháng nguyên tái tổ hợp HIV1 (gp41, p24) và HIV 2 (gp 36).
Kỹ thuật ngưng kết hạt có những ưu điểm sau:
- Các bước tương đối đơn giản, không đòi hỏi nhiều trang thiết bị, thích hợp cho việc xét nghiệm sàng lọc hàng loạt mẫu máu.
- Kỹ thuật này không mất nhiều thời gian như ELISA và kết quả có thể đọc được bằng mắt thường sau 2 giờ.
- Độ nhạy và độ đặc hiệu của kỹ thuật này cao. Tỷ lệ dương tính giả thấp.
Nhược điểm:
- Thao tác phức tap̣ hơn các sinh phẩm nhanh
- Thời gian đoc̣ kết quả lâu hơn sinh phẩm nhanh
- Đòi hỏi cán bô ̣ có kinh nghiệm và thao tác thành thạo
- Hạn sử dụng một số hóa chất sau khi mở là 14 ngày.
Thao tác kỹ thuật ngưng kết hạt gồm 4 bước chính:
- Pha loãng huyết thanh bậc hai vào các giếng của phiến nhưạ vi lượng
- Cho thêm các hạt gelatin có gắn và không gắn kháng nguyên HIV , lắc trộn nhẹ nhàng
- Để yên tĩnh trong 2 giờ
- Đọc kết quả bằng mắt thường.
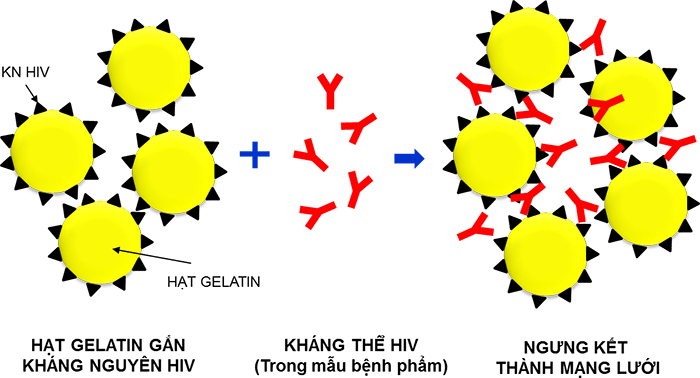
Hình 3: Nguyên lý kỹ thuật ngưng kết hạt
3. Các kỹ thuật miễn dịch gắn enzym ELISA (enzyme-linked immunosorbent assay)
Có ba nguyên lý sau:
3.1. Kỹ thuật ELISA Sandwich
- Kháng thể kháng HIV có trong mẫu thử sẽ kết hợp đặc hiệu với kháng nguyên vi rút đã được cố định trên phiến nhựa vi lượng. Phức hợp kháng nguyên - kháng thể sẽ được phát hiện bởi cộng hợp là các kháng nguyên vi rút gắn enzym khi cho phản ứng hiện màu với cơ chất thích hợp.
- Giá trị mật độ quang (OD: optical density) của phản ứng màu tỷ lệ thuận với lượng kháng thể kháng HIV hiện diện trong mẫu thử.
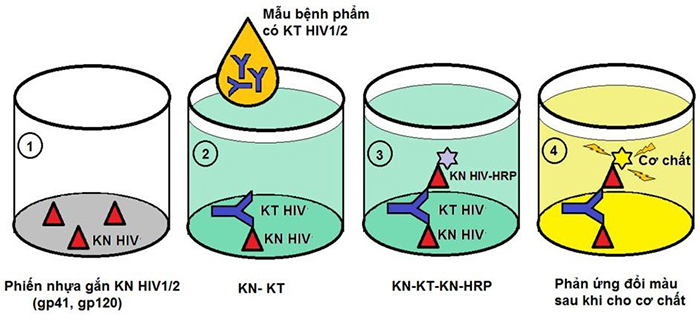
Hình 4: Nguyên lý kỹ thuật ELISA Sandwich
3.2. Kỹ thuật ELISA gián tiếp.
Kháng thể kháng HIV có trong mẫu thử sẽ kết hợp đặc hiệu với kháng nguyên HIV đã được cố định sẵn trên giá đỡ. Phức hợp kháng nguyên - kháng thể này được phát hiện bởi một cộng hợp là một kháng thể kháng immunoglobuline người (Ig) có gắn chất đánh dấu và sẽ cho phản ứng hiện màu/phát quang với một cơ chất thích hợp. Giá trị mật độ quang của phản ứng màu/phát quang tỷ lệ thuận với lượng kháng thể kháng HIV hiện diện trong mẫu thử.
3.3. Kỹ thuật ELISA cạnh tranh.
- Kháng thể kháng HIV có trong mẫu thử sẽ cạnh tranh với cộng hợp là kháng thể kháng HIV có gắn với chất đánh dấu để kết hợp với các kháng nguyên của vi rút đã cố định trên giá đỡ.
- Giá trị mật độ quang tỷ lệ nghịch với lượng kháng thể kháng HIV trong mẫu thử.
Kỹ thuật phát hiện đồng thời kháng nguyên và kháng thể: Một số sinh phẩm dùng kỹ thuật phát hiện đồng thời kháng nguyên vi rút (p24) và kháng thể kháng HIV cho phép phát hiện sớm nhiễm HIV trong giai đoạn chuyển đổi huyết thanh. Kháng nguyên p24 hoặc các kháng thể kháng HIV hiện diện trong mẫu thử kết hợp đặc hiệu với kháng thể kháng p24 và các kháng nguyên vi rút được gắn trên giá đỡ . Phức hợp kháng nguyên - kháng thể sẽ được phát hiện bởi các cộng hợp gắn chất đánh dấu cho phản ứng hiện màu sau khi cho cơ chất.
Dựa trên cách chuẩn bị các kháng nguyên, các sinh phẩm được chia thành 4 thế hệ:
- Sinh phẩm thế hệ thứ nhất sử dụng kháng nguyên là vi rút toàn phần được ly giải và tinh chế từ các tế bào đã gây nhiễm với HIV. Các sinh phẩm này có độ nhạy và độ đặc hiệu hạn chế.
- Sinh phẩm thế hệ thứ hai dùng các kháng nguyên là protein tái tổ hợp. Sinh phẩm có độ nhạy và độ đặc hiệu cao hơn.
- Sinh phẩm thế hệ ba sử dụng các kháng nguyên là các peptite tổng hợp và các protein tái tổ hợp. Độ nhạy và độ đặc hiệu được cải thiện rõ rệt.
- Sinh phẩm thế hệ thứ tư phát hiện đồng thời kháng nguyên P24 và kháng thể có trong mẫu thử. Sinh phẩm này cho phép phát hiện nhiễm HIV trong giai đoạn chuyển đổi huyết thanh và là sinh phẩm được khuyến cáo nên lựa chọn cho kiểm tra an toàn trong truyền máu.
Các sinh phẩm chẩn đoán ngày càng được hoàn thiện để có thể phát hiện sớm và chính xác nhiễm HIV, rút ngắn thời gian cửa sổ huyết thanh.
Ưu điểm và hạn chế của các kỹ thuật ELISA:
- Ưu điểm
+ Cho phép thực hiện đồng thời nhiều mẫu. Có thể dùng máy tự động giảm bớt thao tác cho người làm xét nghiệm, tránh sai sót và lây nhiễm.
+ Đọc kết quả bằng máy không phụ thuộc vào chủ quan của người làm xét nghiệm.
+ Có thể lưu các bảng kết quả và các thông số kỹ thuật thuận lợi cho việc kiểm tra đánh giá chất lượng xét nghiệm.
- Hạn chế
+ Cần có sự đầu tư cho trang thiết bị ban đầu và bảo dưỡng, hiệu chuẩn, hiệu chỉnh máy móc.
+ Cán bộ xét nghiệm phải được đào tạo tốt.
+ Các sinh phẩm phải bảo quản ở nhiệt độ lạnh (4-80C).
+ Thời gian thực hiện xét nghiệm ELISA từ 2-3 giờ.
+ Chỉ thích hợp với những nơi có số lượng mẫu > 40 mẫu/ngày.
4. Kỹ thuật hóa phát quang và điện hóa phát quang:
4.1. Kỹ thuật hóa phát quang: phát hiện đồng thời cả kháng nguyên và kháng thể
Kháng nguyên HIV-1/HIV-2 và kháng thể đơn dòng (chuột) HIV p24 phủ trên bề mặt vi hạt sẽ gắn đặc hiệu với kháng nguyên p24 của HIV và các kháng thể kháng HIV-1/HIV-2 có trong mẫu thử và sẽ được phát hiện bằng sự phát sáng sau khi được kết hợp với cộng hợp là kháng nguyên HIV-1/HIV-2 [tái tổ hợp], peptid tổng hợp và kháng thể HIV p24 [đơn dòng chuột]) gắn chất phát quang (ví dụ acridinium của hãng Abbott) và kết hợp với chất kích hoạt. Kết quả của phản ứng hóa phát quang được tính bằng đơn vị ánh sáng tương đương (RLU). Sự tương quan trực tiếp giữa lượng kháng nguyên HIV và các kháng thể trong mẫu với RLU sẽ được bộ phận quang học trong máy miễn dịch tự động phát hiện. Sự hiện diện có hay không của kháng nguyên HIV p24 hay các kháng thể HIV-1/HIV-2 trong mẫu được xác định bằng cách so sánh tín hiệu hóa phát quang trong phản ứng với tín hiệu ngưỡng xác định trong hiệu chuẩn của hệ thống máy miễn dịch tự động. Mẫu với giá trị tín hiệu ngưỡng (S/CO) lớn hơn hoặc bằng 1,00 được xem là có phản ứng với kháng nguyên HIV p24 hay các kháng thể HIV-1/HIV-2. Mẫu có giá trị S/CO nhỏ hơn 1,00 được xem là không có phản ứng với kháng nguyên HIV p24 hay các kháng thể HIV-1/ HIV-2.
Ưu điểm:
- Độ nhạy được tăng cao hơn so với các kỹ thuật trước đó như: xét nghiệm nhanh, miễn dịch gắn enzym.
- Thời gian cho ra kết quả rút ngắn so với kỹ thuật ELISA.
Nhược điểm: Cần thiết bị đặc hiệu để thực hiện xét nghiệm.
4.2. Kỹ thuật điện hóa phát quang:
Nguyên lý của kỹ thuật dựa trên nguyên lý sandwich dùng để phát hiện đồng thời kháng nguyên HIV p24 và/hoặc các kháng thể kháng HIV-1/HIV-2 có trong mẫu thử.
- Kháng nguyên HIV p24 có trong mẫu thử sẽ kết hợp với các kháng thể đơn dòng kháng kháng nguyên HIV p24 gắn biotin và các kháng thể đơn dòng kháng kháng nguyên HIV p24 gắn ruthenium (chất đánh dấu phát quang). Phức hợp miễn dịch dạng bánh kẹp được tạo ra sẽ bao gồm cả biotin và ruthenium.
- Các kháng thể kháng HIV-1/HIV-2 có mẫu thử sẽ kết hợp với các kháng nguyên tái tổ hợp, các peptid đặc hiệu HIV-1/HIV-2 gắn biotin và các kháng nguyên tái tổ hợp, các peptid đặc hiệu HIV-1/HIV-2 gắn ruthenium. Phức hợp miễn dịch tương ứng được tao ra dưới dạng bánh kẹp.
- Các vi hạt có từ tính phủ streptavidin được thêm vào phản ứng sẽ kết nối với các phức hợp miễn dịch dạng bánh kẹp và tạo ra phức hợp mới thông qua mối liên kết biotin-streptavidin. Phức hợp này được đưa vào buồng đo, nơi các vi hạt có từ tính sẽ được giữ lại trong bề mặt điện cực dưới tác động của từ trường. Sau đó các thành phần khác sẽ được rửa trôi. Phản ứng phát quang diễn ra dưới tác động của dòng diện làm ruthenium bị kích thích và phát ra các photon ánh sáng, các tín hiện này sẽ được khuyếch đại và đo bởi máy nhân quang. Kết quả được tính toán tự động bằng phần mềm của hệ thống máy miễn dịch tự động qua việc so sánh tín hiệu phát quang thu được từ sản phẩm của phản ứng với giá trị tín hiệu ngưỡng.
5. Kỹ thuật WESTERN-BLOT:
Kỹ thuật Western-blot được chỉ định để xét nghiệm khẳng định các mẫu đã có kết quả dương tính với xét nghiệm sàng lọc.
Kỹ thuật Western Blot có độ đặc hiệu rất cao và chỉ dùng để làm xét nghiệm khẳng điṇh mà không dùng làm xét nghiệm sàng lọc .
Kỹ thuật Western Blot có giá thành cao, người thực hiện xét nghiệm và đoc̣ kết quả cần phải có trình độ và kinh nghiệm nhất điṇh nên hiện nay Tổ chức Y tế thế giới (WHO) không khuyến cáo thực hiện thường quy ở những nước đang phát triển. WHO khuyến cáo dùng phối hợp ba xét nghiệm khác nhau về nguyên lý hoặc cách chuẩn bị kháng nguyên theo chiến lược III để chẩn đoán khẳng định trường hơp̣ HIV dương tính.
Trường hơp̣ sử dụng các sinh phẩm để chẩn đoán nhiễm HIV theo chiến lược xét nghiệm III cho kết quả không xác định hoặc khó biện luận, khi đó Western-blot được cân nhắc sử dụng để xét nghiệm.
- Nguyên lý: là một kỹ thuật theo nguyên lý ELISA gián tiếp thực hiện trên băng giấy đã cố định các thành phần kháng nguyên của vi rút ở những vị trí tương ứng theo trọng lượng phân tử. Kỹ thuật Western-blot cho phép xác định kháng thể kháng từng thành phần khác nhau của protein vi rút. Có Western-blot riêng cho HIV-1 và HIV-2.
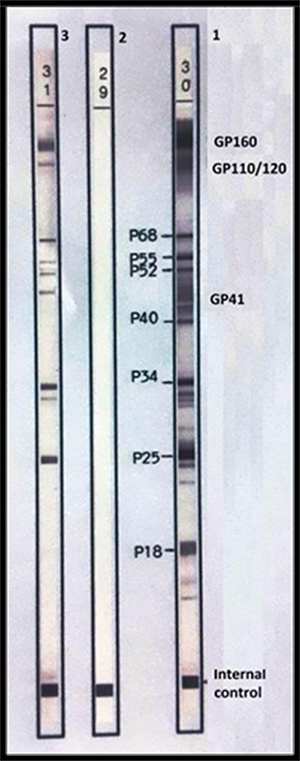
Hình 5: HIV-1 Western-blot
(1 chứng dương; 2 chứng âm; 3 mẫu bệnh nhân dương tính)
- Kỹ thuật: Ủ huyết thanh của mẫu thử với băng giấy. Nếu trong mẫu thử có các kháng thể kháng HIV thì chúng sẽ gắn đặc hiệu lên các protein là kháng nguyên tương ứng và được phát hiện bằng cộng hợp là kháng thể kháng Immunoglobuline người đánh dấu bằng enzyme cho phản ứng màu với cơ chất.
- Kết quả: Vị trí các băng màu tương ứng với kháng thể đặc hiệu với thành phần protein vi rút tương ứng.
- Có nhiều tiêu chuẩn để đọc kết quả Western Blot. Theo WHO xét nghiệm Western Blot HIV-1 dương tính khi xuất hiện ít nhất 02 trong 03 dải băng protein vỏ Env (gp160, gp120, gp41) có thể có hoặc không có các dải băng Gag hoặc Pol. Trường hợp âm tính khi không có bất cứ dải băng nào. Ngoài tiêu chuẩn dương tính và âm tính là trường hợp kết quả không xác định./.